As soluções são classificadas em: saturadas, insaturadas, supersaturadas.
Saturadas
Contêm a quantidade de soluto dissolvido em uma determinada quantidade de solvente, considerando-se constante a temperatura e a pressão (exatamente igual ao coeficiente de solubilidade).
Insaturadas
Soluções nas quais a quantidade de soluto dissolvida é menor que a quantidade máxima que o solvente consegue dissolver, considerando-se constante a temperatura e a pressão (menor que o coeficiente de solubilidade).
Supersaturadas
São soluções nas quais a quantidade de soluto dissolvida supera o coeficiente de solubilidade (na mesma temperatura). Tais soluções são altamente instáveis e qualquer perturbação ou adição de um germe de cristalização provoca a precipitação da quantidade de soluto que está em excesso (em relação à solução saturada), tornando-se uma solução saturada com corpo de fundo.
Aplicações
(Unicamp–SP) Uma solução saturada de nitrato de potássio (KNO3) constituída, além do sal, por 100g de água, está à temperatura de 70°C. Essa solução é resfriada para 40°C, ocorrendo precipitação de parte do sal dissolvido.
Calcule:
a) a massa de sal que se precipitou;
b) a massa de sal que permaneceu em solução.
Considere o gráfico da solubilidade do nitrato de potássio em função da temperatura:
Solubilidade (g de KNO3/100g de H2O)
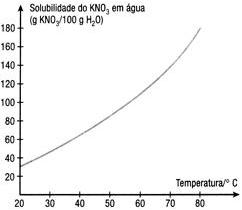
Solução:
Considerando o gráfico, temos:
60g de KNO3/100g de H2O/40°C;
140g de KNO3/100g de H2O/70°C.
a) Com a temperatura variando de 70°C para 40°C, temos 80g de precipitação.
b) Como havia 140g a 70ºC, e precipitou 80g, temos 60g permanentes na solução.
Olá
ResponderExcluirgostei muito do seu blog, miuto bem elaborado,e de um conteúdo riquissimo.Parabéns
Este comentário foi removido pelo autor.
ResponderExcluirNossa... Parabéns o seu blog é simplesmente MARAVILHOSOoO de mais
ResponderExcluir